
-
 专利
专利 -
 商标
商标 -
 版权
版权 -
 商业秘密
商业秘密 -
 反不正当竞争
反不正当竞争 -
 植物新品种
植物新品种 -
 地理标志
地理标志 -
 集成电路布图设计
集成电路布图设计 -
 技术合同
技术合同 -
 传统文化
传统文化
律师动态
更多 >>知产速递
更多 >>审判动态
更多 >>案例聚焦
更多 >>法官视点
更多 >>裁判文书
更多 >>
基本案情
阿里斯康(瑞典)有限公司(以下简称阿里斯康公司)拥有专利号为200780024135.X、名称为“作为用于治疗糖尿病的SGLT2抑制剂的(1S)-1,5-脱水-L-C-(3-((苯基)甲基)苯基)-D-葡萄糖醇衍生物与氨基酸的结晶溶剂合物和络合物”的发明专利(以下简称涉案专利),涉案专利目前处于有效状态,其权利要求1和9内容如下:
“1.具有式Ia的结晶结构
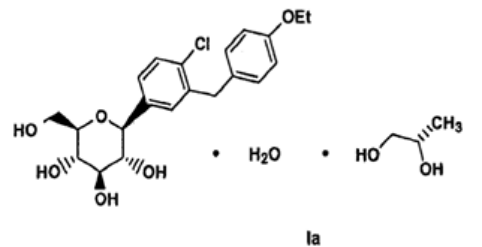
其特征在于粉末X-射线衍射图如图1所示。
9.权利要求1所述的结晶结构在制备用于治疗哺乳动物的糖尿病、胰岛素抵抗、高血糖、高胰岛素血症、脂肪酸或甘油的升高的血含量、高脂血、血脂障碍、肥胖、或糖尿病并发症的药物方面的用途。”
涉案专利权利要求9及与之相关联的达格列净片(10mg)(以下简称涉案原研药)已由阿里斯康公司登记在专利信息登记平台上。四川国为制药有限公司(以下简称四川国为公司)以涉案原研药为仿制药,于2021年11月29日提交的涉案仿制药的上市许可申请已被受理。四川国为公司提交了针对涉案专利的4.1类声明,即涉案专利权应当被宣告无效。
2022年4月2日,北京知识产权法院受理了阿斯利康公司提起的民事诉讼,阿斯利康公司指控四川国为公司申请上市许可的涉案仿制药落入涉案专利权利要求9的保护范围。四川国为公司辩称,阿斯利康公司主张保护的权利要求9实质上的是晶型专利,不属于药品专利链接案件审理的专利类型,阿斯利康公司无权依据专利法第七十六条起诉。
一审法院判决认定涉案专利权利要求9不属于晶型专利,而属于用途专利,确认涉案仿制药的技术方案落入涉案专利权利要求9的保护范围
《药品专利纠纷早期解决机制实施办法(试行)》(以下简称药品专利纠纷实施办法)五条规定:“化学药上市许可持有人可在中国上市药品专利信息登记平台登记药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利。”该条款从保护主题角度对可依据专利法第七十六条提起诉讼的专利范围进行了规定,而晶型专利并未被涵盖在上述规定中。
对于何为晶型专利,一审法院认为,需要从权利要求保护范围的角度进行分析。如果相关权利要求的保护范围内仅仅包括化合物的晶型特征,则应认定其属于晶型专利。但如果相关权利要求的保护范围内既包括晶型特征,亦包括其他技术特征,则不应被认定为晶型专利。
本案中,涉案专利权利要求9作为用途权利要求,其保护范围内不仅包含晶型特征,亦包括用途特征,故该权利要求不属于晶型专利,应被认定为前述条款中的用途专利。四川国为公司有关涉案专利权利要求9属于晶型专利,阿斯利康公司无权依据专利法第七十六条提起本案诉讼的主张不能成立。
在此基础上,因国为公司对于涉案专利仿制药的技术方案落入涉案专利权利要求9的保护范围并无异议,故阿斯利康公司的相关主张成立,应当予以支持。
北京知识产权法院于2022年11月18日作出(2022)京73民初586号民事判决,确认涉案仿制药的技术方案落入涉案专利权利要求9的保护范围。四川国为公司不服一审判决,上诉至最高人民法院。
最高人民法院二审认定涉案专利权利要求9属于晶型专利,裁定撤销一审判决,驳回阿斯利康公司的起诉
二审法院将本案的争议焦点确定为:涉案专利权利要求9是否属于药品专利纠纷实施办法规定的可登记专利类型及对本案的影响。二审法院对此进行了详细分析:
(一)关于人民法院在药品专利链接纠纷案件中对涉案专利是否属于可登记专利类型的审查
当事人依据专利法第七十六条第一款提起的诉讼应系因申请注册的药品相关的专利权产生的纠纷提起的诉讼,当事人据以主张权利的专利权应与申请注册的药品相关。
根据药品专利纠纷实施办法规定,在当事人对于涉案专利是否属于可登记专利类型有争议时,人民法院应当在案件审理过程中对此进行审查;发现当事人据以主张权利的专利权要求不属于可登记专利类型的,应当裁定驳回起诉。
(二)关于对药品专利纠纷实施办法第五条规定的可登记专利类型的理解
对于药品专利纠纷实施办法五条规定的三种可登记专利类型所涵盖的范围,应从文义解释、目的解释、历史解释等多角度进行综合认定。
首先,从文义解释的角度看,如果将“医药用途专利”理解为任何物质的医药用途专利,会不当扩大可登记的专利范围。应将“医药用途专利”解释为药物活性成分化合物的医药用途专利和含活性成分的药物组合物的医药用途专利。
其次,从目的解释的角度看,药品专利纠纷早期解决机制的立法目的在于,保护原研药专利权与鼓励仿制药发展并重,提高药品可及性。对适用于这一特殊机制的药品专利范围原则上不能随意扩大解释。对于在已有的以分子结构表达的化合物基础上进一步表征的结晶结构的化合物专利,其一般是在分子结构层面的化合物发挥药理活性的基础上,通过限定分子的具体排列方式而改进生物利用度等效果。综合立法目的和药品专利纠纷实施办法第五条规定,尚不宜将该类专利纳入可登记专利范围。
最后,从历史解释的角度看,药品专利纠纷实施办法政策解读可以作为解释药品专利纠纷实施办法的重要参考。实施办法政策解读从反向强调“相关专利不包括中间体、代谢产物、晶型、制备方法、检测方法等的专利”。
综上,在已有分子结构表达的化合物基础上进一步表征的结晶结构化合物专利以及包含该化合物的组合物专利不应包含在药品专利纠纷实施办法规定可登记的专利类型范围内。
(三)关于涉案专利权利要求是否属于可登记专利类型
权利要求1要求保护一种结晶结构,该结晶结构的具体技术特征由附图1所示的粉末X-射线衍射图进行了明确。权利要求9引用权利要求1,所载内容也是该结晶结构的具体用途,不属于医药用途专利,不属于药品专利纠纷实施办法第五条规定的三种专利类型。因此,阿斯利康公司无权依据专利法第七十六条提起本案诉讼,其起诉应予驳回。
综上所述,四川国为公司的上诉请求成立,应予支持。2023年6月14日,最高人民法院作出(2023)最高法知民终7号民事裁定书,裁定撤销一审判决,驳回阿斯利康公司的起诉。
由此可见,最高人民法院对于中国专利链接制度中的可登记专利类型作出了限缩性解释,这将有助于平衡原研药企业与仿制药企业之间的利益平衡,提高药品的可及性。
中国的药品专利链接制度
所谓药品专利链接制度,是指在药品领域,将仿制药的上市审批与原研药专利的有效性、保护期链接起来,将解决纠纷的时间提前,以避免事后解决侵权纠纷所带来的不必要麻烦。药品专利链接制度肇始于美国。根据《中美第一阶段经贸协议》第一章第三节约定,如果中国允许仿制药企业使用原研药的安全性和有效性证据或信息申请上市审批,则中国应规定制度让仿制药企业通知原研药专利权人、被许可人或上市许可持有人,并规定足够的时间、机会,让原研药专利权人、被许可人或上市许可持有人依照法定的民事司法程序,就可适用专利的有效性或侵权的纠纷解决提起诉讼。中国还可提供行政程序解决此类纠纷。
根据上述约定,中国有必要设立药品专利链接制度。
于2020年修改、自2021年6月1日起施行的中国专利法新增第七十六条规定,相应地,国家药监局、国家知识产权局于2021年7月4日发布《药品专利纠纷早期解决机制实施办法(试行)》(以下简称药品专利纠纷实施办法),国家知识产权局于2021年7月5日发布《药品专利纠纷早期解决机制行政裁决办法》,最高人民法院同日发布《关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》(以下简称药品专利纠纷司法解释),至此,中国已基本建立起较为完备的药品专利链接制度。
提到专利链接,就不能不提Bolar例外制度。在Bolar v. Roche案中,美国联邦巡回上诉法院(CFCA)认为,Bolar为仿制药进行的相关试验具有商业目的,不属于专利法规定的不视为侵权的实验研究,故而构成专利侵权;但是,在原研药专利保护期届满前禁止仿制药的相关试验,实际上等于变相延长了原研药的专利保护期,应当通过立法解决这一问题。在Bolar的积极推动下,美国通过了Hatch-Waxman法案,该法案确立了以下规则:目的在于单纯为了获得和提交仿制药审批所需信息而在美国制造、销售、许诺销售或向美国进口专利药品或专利医疗器械的行为不构成侵犯专利权行为。
该规则称为Bolar例外,被写进了美国专利法第271条。
Bolar例外即试验例外,于2008年修改、自2009年10月1日起施行的中国专利法第六十九条(2020年修正专利法第七十五条第五项)引入了Bolar例外制度,增加了一项不视为侵犯专利权的情形:为提供行政审批所需要的信息,制造、使用、进口专利药品或者专利医疗器械的,以及专门为其制造、进口专利药品或者专利医疗器械的。
Bolar例外制度给仿制药企业的申请仿制药上市带来了很大的便利,使仿制药能否尽早进入市场,但也产生了一些弊端,为此,美国又规定,仿制药企业申请仿制药上市时,须提交四类声明之一。中国国家药监局、国家知识产权局于2021年7月4日发布的药品专利纠纷实施办法第六条第一款对一至四类声明作出规定,其中四类声明为:中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
上述四类声明,被称为专利挑战。
为防止专利挑战权被滥用,美国又发明了拟制侵权制度,这项制度也被写进了美国专利法第271条。依据该条款,以取得仿制药上市许可为目的的相关使用原研药专利的行为被拟制为专利侵权行为,如果原研药专利权人或利害关系人对四类声明有异议,可在法定期限内向法院提起专利侵权诉讼,仿制药企业也可以向法院提起确认专利无效的诉讼。如果专利侵权诉讼被启动,药品上市审批机构将暂停对仿制药的上市审批。
中国专利法七十六条规定:“药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。
药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。”
上述条款确立了中国的药品专利早期纠纷解决机制。需注意的是,中国的药品专利早期纠纷解决机制不同于美国的早期纠纷解决机制,中国并未采用美国的拟制侵权制度理论,而是“另辟蹊径”,形似中立,原研药专利权人或利害关系人、仿制药企业可以据此请求人民法院确认仿制药的技术方案是否落入原研药专利权利要求的保护范围。








 首页
首页




评论