
-
 专利
专利 -
 商标
商标 -
 版权
版权 -
 商业秘密
商业秘密 -
 反不正当竞争
反不正当竞争 -
 植物新品种
植物新品种 -
 地理标志
地理标志 -
 集成电路布图设计
集成电路布图设计 -
 技术合同
技术合同 -
 传统文化
传统文化
律师动态
更多 >>知产速递
更多 >>审判动态
更多 >>案例聚焦
更多 >>法官视点
更多 >>裁判文书
更多 >>摘要:
协同作用是医药领域组合发明专利申请中时常出现的用语,其认定对专利申请创造性的判断具有重要作用。本文梳理了协同作用的定义和评价方法,辨析了审查实践中对药物组合协同作用技术效果的认定出现分歧的原因,并从协同作用与预料不到的技术效果、显著性差异的关系,以及协同作用效果证明等方面提示了审查医药组合专利申请的注意事项。
关键词:
协同作用 创造性 组合发明 医药
一、引言
组合发明,是指将某些技术方案进行组合,构成一项新的技术方案,以解决现有技术客观存在的技术问题。组合发明的创造性判断通常需要考虑:组合后的各技术特征在功能上是否彼此相互支持、组合的难易程度、现有技术中是否存在组合的启示以及组合后的技术效果等。如果组合的各技术特征在功能上彼此支持,并取得了新的技术效果;或者说组合后的技术效果比每个技术特征效果的总和更优越,则这种组合具有突出的实质性特点和显著的进步,发明具备创造性。
组合发明是医药领域的常见发明类型,将两种或两种以上药物组合用于相同的医药用途是本领域技术人员比较常见的技术追求。因此,在药物组合发明专利申请的审查实践中,药物活性成分之间是否产生协同作用,进而带来预料不到的技术效果是审查员较为关注的焦点问题,也是申请人/请求人经常用于支持其专利申请具备创造性主张的关键点。本文从一件药物组合物案例出发,梳理分析其中对药物间协同作用认定出现分歧的原因,并对涉及协同作用的药物组合专利申请审查提出建议。
二、具体案例
第200780049146.3号专利申请涉及一种药物组合物,其包括A利伐沙班、B乙酰基水杨酸和C氯吡格雷。说明书通过大鼠动静脉旁路模型测定抗血栓作用,单独剂量的利伐沙班没有效果,乙酰基水杨酸和氯吡格雷的组合无效或效果非常弱,三种药物的组合则使血栓重量显著减少(见表1)。试验结论认为,利伐沙班与乙酰基水杨酸、氯吡格雷的组合实现了协同效果,三种组分具有互相加强的作用。
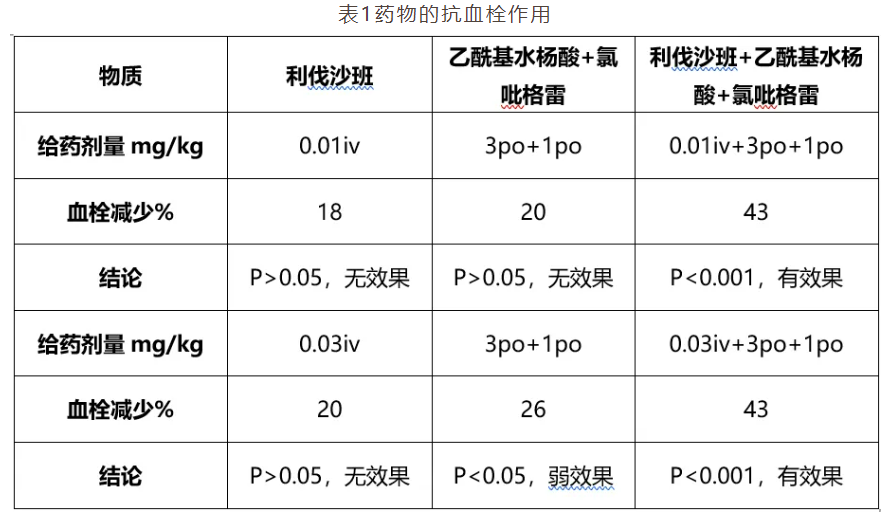
该专利申请实质审查阶段的第一次审查意见通知书中指出,虽然三种药物组合的效果比单独药物或者两种药物的组合更好,但这种效果是基于实际药物剂量增加而获得的,不能认为是协同效果。申请人争辩称,每种药物单独给药时p>0.05,对机体不会有任何作用,相同剂量的药物组合后p<0.001,对机体产生了作用,即每种药物的作用被其他药物增强,因而获得协同效果。最终,该申请被授予专利权。
之后,该专利被提起无效宣告请求,合议组经过审理后作出无效宣告请求审查决定。决定认为,p值通常是指在一个概率模型中,统计某一事件发生的概率,其不是反映物质之间产生协同增效作用的标准参数模型。而且在该表1中,p值反映的是给药组抗血栓形成相对于对照组的差异水平,不是利伐沙班+氯吡格雷+乙酰基水杨酸抗血栓形成相对于利伐沙班或氯吡格雷+乙酰基水杨酸的p值,不能反映出利伐沙班+氯吡格雷+乙酰基水杨酸抗血栓形成相对于利伐沙班或氯吡格雷+乙酰基水杨酸产生协同作用。
从该专利申请的授权程序和确权程序可以看出,申请人、实审审查员和合议组对同一实验数据作出了不同的认定,具体表现为对实验数据是否反映出三种药物之间产生协同的认定不同。事实上,这种认识差异在专利审查实践中并不鲜见。
三、追因溯果
之所以产生上述认识上的差异,原因可能与专利审查关于协同作用的认定标准、业界对协同作用的定义、协同作用的计算方法等相关,下文将对此一一辨析。
1.专利审查认定协同作用的标准较为一致
在我国,专利法、专利法实施细则和《专利审查指南》(下文简称“指南”)均未明确使用“协同作用”的表述。指南第二部分第四章4.2节规定,如果组合的各技术特征在功能上彼此支持,并取得了新的技术效果;或者说组合后的技术效果比每个技术特征效果的总和更优越,则这种组合具有突出的实质性特点和显著的进步,发明具备创造性。其中“组合后的技术效果比每个技术特征效果的总和更优越”为协同作用的判断标准提供依据。诸多案例表明,审查审判实践也是采用这样的标准来确定协同作用的。例如“CS-866案”[1]中合议组认为,协同作用是指两种药物组合的响应大于分别单独用药响应的总和,药物联用后效果比单药更好并不等同于两药联用具有协同作用。“缬沙坦案”[2]中法院认为,协同作用不同于药物联用后在效果上的简单叠加,而是通常体现为“1+1>2”的实质性提升。
在欧洲,《欧洲专利局审查指南》[3]C部11.5节对“组合、并列和集合”进行了区分,如果一组技术特征中的各特征之间功能上的相互作用达到的技术效果不同于(例如大于)各个特征的技术效果之和,则认为是特征的组合。换言之,特征的组合中,各个特征的相互作用必须产生协同效应。如果不存在协同效应,则仅是特征的集合。《欧洲专利局上诉委员会判例法》[4]第9.2.1节进一步对协同作用进行了释义:如果两个特征的功能是相互关联且产生了超出每个特征单独采用的效果总和的附加效果,则两个特征产生相互协同作用。
在美国,《美国专利审查操作指南》未明确给出协同作用的概念,但通过判例的形式明确了协同作用的认定标准。在1950年的Supermarket案[5]中提出了协同作用认定标准:已知要素的联合必须有所贡献,只有整体上以某种方式超出了已知要素的功能总和才具备专利性。在“Black Rock案”[6]中,美国最高法院解释,协同作用是指部件的组合取得大于各部件总和的技术效果。
由此可见,在国内外专利审查审判实践中,对协同作用的认定标准较为一致,即特征组合后的效果大于各特征单独效果之和,简言之“1+1>2”。
2.业界对协同作用的定义并不完全一致
虽然不同国家/地区的专利审查中对协同作用的认定标准较为一致,但业界对协同作用的定义却并不完全一致。从词语来源和含义看,“协同”一词见诸于诸多古籍中。东汉许慎在《说文解字》中将“协”解释为“协,众之同和也”,指齐心协力的意思;而将“同”解释为“同,合会也”,意思是“聚集”。两字合为一体,即为“协同”。《辞海》[7]将“协同”解释为同心合力、相互配合。西方的“协同”(Synergetics)一词则源自于古希腊语Synergy,含义指的是“为了共同利益或目标,多个不同的全体或个体协调一致地实现目标的协作过程或能力”。可见,国内外对“协同”的定义较为类似,仅指两者的“相互配合”。
协同作用在具体运用领域的定义通常因研究对象的不同而各不相同。在药物领域,协同与相加、拮抗一起,用于评价药物组合应用时的药物效应。但是,其定义多年来一直没有统一,Chou[8]曾列举了从1874-1995年有关协同和拮抗定义的相关重要论述31篇。观点一[9-11]认为,协同是实际药效大于预期的相加作用,即药物之间发生了相互增强的作用;相加是实际药效等于预期的相加作用,药物之间实际上没有发生相互作用;拮抗是实际药效小于预期相加作用,药物之间发生了相互减弱的作用。通俗形象地说,相加为“1+1=2”,而协同为“1+1>2”,拮抗为“1+1<2”。观点二[7、12-14]则认为,药物的协同不仅包括实际药效大于预期的相加作用,也包括了实际药效等于预期的相加作用,即相加作用和增强作用都归为协同作用。两种观点长期相互争论不休,虽然业界逐步趋向认同观点一,但观点二存在于《辞海》[7]《临床用药大全》[12]《药学专业知识》[13]《中药药剂学》[14]等权威工具书中,仍然具有相当的影响力。到目前为止,国家药品监督管理部门也未通过正式文件对协同作用进行明确定义。
3.药物协同作用的评价方法种类繁多
协同作用是一种数量比较关系,从数学函数或者量效曲线的层面去定义药物相互作用具有非常重要的意义。但是药物的剂量-效应关系不是直线,而是曲线。在一定范围内,药物剂量加大一倍,其效应不一定是原剂量效应的两倍。例如,A药物、B药物在10mg剂量下治疗甲病的有效率分别为60%、70%,那么10mgA药物+10mgB药物治疗甲病的有效率不可能为130%。因而,药物的相互作用需要在数学上进行精确计算分析。自1871年Fraser[15]首次用图解法表征两个药物的相互作用起,100多年来有许多学者描述了多种的计算方法,仅Greco[16]在一篇综述中归纳总结的协同作用的计算方法就有13种之多,尚未形成统一确定的计算方法。
专利技术来源于科技工作者的科学实践,专利申请文件通常也是在申请人/发明人的技术交底书上加工形成的法律文件。当专利申请涉及到组合发明的协同作用的证明时,其中难免带上申请人/发明人本身对协同作用的理解及其对证明方法的选择,而其理解和选择是否与专利审查对协同作用的认定一致需要进一步判断。业界对协同作用的定义以及协同作用的计算方法的不统一可能是导致审查实践中对协同作用的认定不一致的重要原因。
4.实践较为认可的协同作用计算方法
虽然目前尚未形成统一确定的计算方法,但仍有部分协同作用评价方法得到业界的普遍认可。为了便于下文讨论和为案件审查审判提供参考,在此对实践较为认可的协同作用计算方法做些介绍。最为经典方法是Loewe的等效线相加模型和Bliss的独立模型[17-18]。
(1)Loewe等效线相加模型[19]
将两个药物A和B单用时达到某一效应水平的剂量DA和DB,分别表示于直角坐标系的X轴和Y轴上,连接两点的直线,可得到式(I)所示的截距式直线方程。
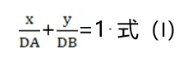
Loewe指出,当两药以较小剂量a和b联合应用时,达到单用药物剂量DA或DB产生的效应时,则存在式(II)所示的关系,其中CI是指联用指数(Combination Index, CI)数值。
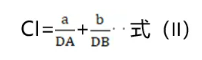
当CI<1为协同,联用剂量点位于直线下方;CI=1为相加,联用剂量点位于直线上;CI>1为拮抗,联用剂量点位于直线上方。
该计算方法目前被广泛使用,但适用范围有限,只能用于作用机制相同或相似的两种药物,把剂量比等同于效应比,难以用于更多种药物联合应用的评价。
(2)Chou-Talalay合并指数(Combination Index)法
该方法又称为半效法、周氏法,本质上与Loewe等效线相加模型相同。其基本公式为式(III)。
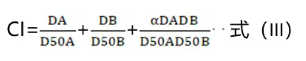
α=0时,表示药物单用药和联用药的三条量效线平行,代表药物呈现相似的联合作用,药物间具有相似的作用机制,此时与Loewe等效线相加模型相同;α=1时,表示三条量效线不平行,代表药物呈现独立的联合作用,药物间的作用机制不同;CI=1为相加,CI<1为协同,CI>1为拮抗。
(3)FIC指数法
FIC指数法即分级抑菌浓度(Fractional Inhibitory Concentration,FIC)指数法,也是基于Loewe等效线相加模型推导而来的,用于两种抗菌药的联合药敏评价。其计算公式为式(IV)。

若FIC≤0.5,则表示两药具有协同作用;若0.5<FIC≤1,则表现出相加作用;若1<FIC<2,则表现为不相关作用:若FIC≥2,则表现为拮抗作用。FIC指数越小,表示两药的协同作用越强。该方法局限于抗菌药物,应用领域较为狭窄。
(4)Bliss独立模型和金氏法
以药物作用对象的发生率作为药效指标,药效的量值范围则为0 ~ 1。以药物A和药物B为例,将药物A和药物B的药物效应看成是独立的事件,借用概率公式PAB=PA+PB-PA*PB,将该公式作为药物联合应用预期相加效应的计算公式EAB=EA+EB-EA*EB。将实际药效值与该公式计算所得的比值为CI,计算公式如式(V)。

CI>1为协同,CI=1为相加,CI<1为拮抗。
Bliss独立模型法将概率相加公式引入,将从实验中得到单用药物A、单用药物B和联合用药A+B的药效值(发生率),根据上述公式直接计算CI值。但该方法仅适用于质效应药物,仅把两药合用看做是两个孤立事件发生概率的相加,缺乏药物A和药物B各自的量效关系。用该方法计算得出的数值,无法确定是否是预期相加效应值。
金氏法是国内应用较多的方法,其表达式与Bliss独立模型完全一样,只不过对CI值的意义做出了一些解释,如:CI值介于0.85~1.15之间为单纯相加;1.15~20之间为增强,>20为显著增强;CI值在0.85~0.55之间为拮抗,<0.55为明显拮抗。
(5)Bürgi公式法
又称为效应比方法,其原理是:两个药物等效剂量一半之和应与原效应相等,大于原效应的为协同作用,小于原效应的为拮抗作用。其检验公式如式(Ⅵ)。
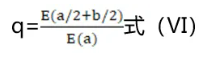
若q>1为协同、q=1为相加,q<1为拮抗。公式中a与b分别为A与B药的两个等效剂量,E(a)=E(b)。
该方法由于不考虑剂量与反应关系以及合并药的不同作用方式而局限了它的应用。Chou[8]认为,仅从各个药物及合并后的单剂量是不可能决定联合作用性质的,因为S型的剂量-反应曲线及不同斜度可使Bürgi方法所评价的联合作用性质随反应或剂量水平的不同而异。
四、药物组合物协同作用审查的注意事项
如前文所分析的,在专利审查审判实践中,对协同作用的认定标准较为一致,即特征组合后的效果大于各特征单独效果之和。对于药物组合物发明来说,如果申请文件记载了以业界公认计算方法得出药物之间产生“1+1>2”效果,该发明通常被认为具备创造性。例如,“吉非替尼案”[20]涉及一种抗肺癌药物组合物,是吉非替尼和薯蓣皂素的联合。申请中记载了联合用药对H460的细胞存活率,计算了合并指数CI,并根据“CI<1,协同作用;CI=1,相加作用;CI>1,拮抗作用”,判断两者具有协同作用。“地美硝唑案”[21]要求保护地美硝唑和头孢噻肟的药物组合物在制备抗大肠杆菌药物中的应用,对两药联用的最低抑菌浓度进行了测定,并使用FIC指数法对其相互作用关系进行了判断。“β-内酰胺酶抑制剂案”[22]同样也使用FIC指数法。但是在药物组合发明专利审查中,以下三个方面仍值得关注。
1.协同作用不必然带来预料不到的技术效果
在审查实践中,需将协同作用与预料不到的技术效果进行区分。预料不到的技术效果是指发明同现有技术相比,其技术效果产生“质”的变化,具有新的性能,或者产生“量”的变化,超出人们预期的想象。因而,预料不到的技术效果的审查是将本发明的药物组合与现有技术整体尤其是最接近的现有技术进行对比,判断发明的技术效果相对于现有技术的效果是否超出了本领域技术人员的预期。而协同作用考察的是药物之间的相互作用关系,将组合药物与单个药物效果进行对比,通过计算得出药物之间是否产生了协同作用。协同作用是进一步判断药物组合是否带来预料不到的技术效果的事实基础。
“VEGF Trap案”[23]涉及VEGF Trap与伊立替康的药物组合在制备治疗肿瘤疾病的药物中的用途,最接近的现有技术是VEGF Trap与紫杉醇的组合对抑制肿瘤生长具有协同效果。复审请求审查决定认为,在一种药物的基础上叠加另一种具有同样治疗作用的药物,即VEGF Trap叠加伊立替康,所获得的优于单一药物的疗效属于药效的相加作用,并非协同作用,该发明不具备创造性。而法院一审判决认为,本申请的最接近现有技术已经明确记载VEGF Trap与紫杉醇联用可产生协同抑制肿瘤的效果,因而本发明是在最接近的现有技术的基础上的要素变更发明,即将VEGF Trap与紫杉醇的组合中的紫杉醇替换成伊立替康。创造性审查时应当主要考虑采用伊立替康替换紫杉醇的难易程度以及替换后是否具有协同作用的可预期性。由于伊立替康与紫杉醇同属于抗肿瘤植物药,在无其他相反技术教导的情况下,本领域技术人员有动机将紫杉醇替换为伊立替康并能预期VEGF Trap与伊立替康联用同样具有协同效果,即VEGF Trap与伊立替康的药物组合的作用是可预期的。
2.显著性差异不完全等于协同作用
专利申请文件中经常出现效果具有显著性差异的记载,申请人往往会因此主张药物之间存在协同作用。但实际上,效果具有显著性差异与协同作用并非完全等同的概念。显著性差异通常用于判断实验处理组与对照组或两种不同处理组之间的效应是否有差异,以及这种差异是否显著,其依据的是小概率事件实际不可能性原理,如果是“不显著”,就说明两者之间的差异是由抽样或偶然的因素引起的,不是真正有实际差异存在[24]。
显著性差异常用的检验模型包括t检验、t’检验、方差分析如q检验或LST检验、卡方检验等。在数理统计中,一般以概率(P)5%作为显著评定标准,即在100次试验中,由于偶然因素造成差异的可能性在5次以上,两者之间的差异被认为不显著。如果两者差异在概率为5%的范围内(P<0.05),则偶然因素较小,可以认为两者之间的差数具有显著差异。如果P<0.01,则认为两者之间差数具有极显著的差异。如果两组数据之间存在显著性差异,例如,P<0.05或P<0.01,只能表示两组数据整体不同的概率>95%或>99%,但不说明两组数据间差值的大小。在实际中,统计学上差异非常显著时,两组均数间数值的差别可能很大也可能不大。如果专利申请的说明书仅仅记载了显著性差异检验,则尚不能证明药物联用具有协同作用。
3.证明协同作用的推导过程要科学合理
判断说明书记载的实验数据是否足以证明药物组合之间产生协同作用,实际上是对实验数据证明力的审查过程。因此,应当审查说明书记载的给药方案、实验方法等试验方案是否清楚完整,使得本领域技术人员能够重复实施,并进一步判断依据说明书记载的试验数据得出药物组合产生协同作用结论的推论过程是否科学和合理。
“CS-866案”[1]涉及HCTZ和CS-866的组合在降血压中的制药用途,实施例1是CS-866与HCTZ联合用药的降压效果试验,将28只高血压自然发病大鼠分为四组,分别为对照组(组1)、HCTZ给予组(组2,10mg/kg)、CS-866给予组(组3,1mg/kg)和联合用药组(组4,HCTZ10mg/kg+CS-8661mg/kg),连续14天经口给予相应药物,测定给予前日、给予后第7天和给予后第14天的血压,血压测定值如下表2所示。
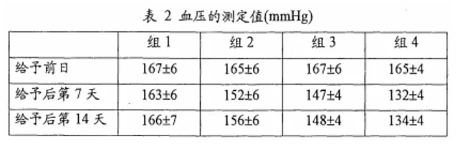
专利权人认为,将A(对照组数据)+D(联合用药组数据)和B(单独给药X组数据)+C(单独给药Y组数据)进行比较,如果A+D<B+C,则联合用药组具有协同作用。经计算,实施例1第7天(163+132<152+147,两者差值为4)和第14天(166+134<156+148,两者差值为4)均为A+D<B+C,HCTZ和CS-866之间产生协同作用。
合议组认为,专利权人的专家证人对根据A+D<B+C来判断协同作用进行说明,即X和Y的累加作用由{(A-B)+(A-C)}给出,将其与X/Y组合作用(A-D)比较,以观察(A-D)是否显著大于累加作用,即是否产生协同作用。{(A-B)+(A-C)}与(A-D)的比较变形为A+D和B+C之间的比较,两者差值是否显著小于零可以通过单侧t-检验来测试。即该测试方法需要考察A+D和B+C之间的差异是否具有统计学意义,专利权人仅依据A+D<B+C得出产生协同作用的结论是不当的。根据组1的数据可知,空白对照组用药前和用药后第7天的平均值差值为4,即在不使用药物的情况下,试验过程也可能有平均值为4的血压降低,表中各组数值也均存在4-7的标准误差,实验数据明显存在一定的偶然性和随机性。经计算,表2中第7天、第14天的B+C与A+D的差值均仅为4,未超出4-7的标准误差范围,不能合理得出药物组合具有协同作用的结论。
五、结语
由于医药领域对协同作用的定义还存在不同的理解,加之协同作用的评价方法种类繁多,使得实践中对药物协同作用的认定出现分歧。需要注意的是,在审查中应当明晰专利申请文件中协同作用的具体含义,协同作用与预料不到的技术效果、显著性差异不是完全等同的概念,在审查中需进一步加以厘清。最后,如果说明书记载的试验方案清楚、完整,使得本领域技术人员能够重复实施,则应当进一步判断协同作用的推论过程是否科学和合理,如果无法排除偶然性和随机性因素的影响,或者推导过程明显不科学、不合理,则无法得出具有协同作用的结论。
参考文献:
[1]第4W111325号无效宣告请求审查决定书.
[2](2018)京73行初6483号判决书.
[3]审查业务管理部组织翻译.欧洲专利局审查指南[M].知识产权出版社,2012:76-77.
[4]国家知识产权局学术委员会.欧洲专利局上述委员会判例法I.D.创造性[M].2020:100.
[5]Great Atlantic & Pacific Tea Co. v.Supermarket Equipment Corp.,340 U.S. 147(1950).
[6] Anderson's-Black Rock, Inc., v.Pavement Salvage Co., 396 U.S. 57 (1969)
[7]辞海.上海辞书出版社.第7版[M]. 上海辞书出版社,2020.09:474.
[8]Chou TC. Theoretical basis,experimental design,and computerized simulation of synergism and antagonism in drug combination studies[J].Pharmacol Rev,2006(3):621-681.
[9]Berenbaum MC. What is synergy?[J]. Pharmacol Rev,1989(2):93-141.
[10]郑青山,李见春.数学药理学新论-药物相互作用动力学[M].人民卫生出版社,2004:131-184.
[11]罗非,韩念霖,韩济生.关于药物协同作用的几种计算方法[J].生理科学进展,1995(03):276-280.
[12]孙琛.临床用药大全[M].中国大百科全书出版社上海分社,1995:23.
[13]尤启冬.药学专业知识[M].中国医药科技出版社,2020:357.
[14]杨明.中药药剂学[M].中国医药科技出版社,2021:375.
[15]Fraser TR.An experimental research on the antagonism between the action of physostigma and atropia[J]. Proc R Soc Edin,1871(7):506-511.
[16]Greco R, Bravo G, Parsons C. The search for synergy:a critical review from a response surface perspective[J]. Pharmacol Rev,1995(2):331-385.
[17]徐端正. 药物联用作用评价[J].生理科学进展,1992(3):248-253.
[18]袁守军. 多药合用药效学协同、相加和拮抗定量计算新方法的建立[J].中国药理学与毒理学杂志,2016(12):1316-1332.
[19]袁守军. 多药合用药效相加的数学规律及协同拮抗的定量计算方法[M]. 江苏凤凰科学技术出版社,2016:3-17.
[20] CN202110805916.4授权文本及审查过程.
[21] CN202210332764.5授权文本及审查过程.
[22] CN202110626319.5授权文本及审查过程.
[23](2015)京知行初字第318号判决书.
[24]张正新. 计量经济学实验指导书[M].西南交通大学出版社,2018:51.







 首页
首页 上一篇
上一篇 





评论