
-
 专利
专利 -
 商标
商标 -
 版权
版权 -
 商业秘密
商业秘密 -
 反不正当竞争
反不正当竞争 -
 植物新品种
植物新品种 -
 地理标志
地理标志 -
 集成电路布图设计
集成电路布图设计 -
 技术合同
技术合同 -
 传统文化
传统文化
律师动态
更多 >>知产速递
更多 >>审判动态
更多 >>案例聚焦
更多 >>法官视点
更多 >>裁判文书
更多 >>摘要:
药物晶型由于其特殊的性质,近年来成为药物研发的重点。对于药物晶型的专利无效挑战也日渐增多,但是仅仅依据新颖性这项无效理由挑战成功的案例为数不多,对于药物晶型新颖性的审查标准众说纷纭。本文试图借助一些案例探讨无效程序中药物晶型专利新颖性判定的审查标准。
关键词:
药物晶型,新颖性,无效,实际公开,推定公开
一、引言
药物基础化合物可能存在多种不同的晶体形式,“同一化学结构的药物,因为结晶条件(如溶剂、温度、冷却速度等)的不同,而得到不同晶格排列的结晶,称为多晶型”1,同一药物化合物的不同多晶型性质不同,对成药性和药物的功效也有不同的影响。人用药品注册技术要求国际协调会(the International Council for Pharmaceuticals for Human Use,ICH)在《药品注册的国际技术要求质量部分》一书中明确,“有些新原料药以不同晶型存在,不同晶型物理性质不同,在某些情况下,形态不同可影响新药制剂的质量或功效,如果不同晶型会影响功效、生物利用度或稳定性,就应规定适当的固体晶型”2。也有学者研究发现,造成国产药物与进口药物、不同企业生产的同种药物、同一企业的不同生产批号药物临床疗效差异的原因多数来自固体化学药物的晶型物质存在状态的变化3。一方面,不同的晶型可能因在体内的溶解和吸收不同影响到药物的溶出与释放,进而影响到药物的疗效和安全性;另一方面,不同的晶型可能因具有不同的稳定性、吸湿性甚至外形,影响到药物的制备、加工和贮存4。可见,研究表明药物多晶型与药物的作用和用药安全之间存在着直接的关系。随着对药物多晶型研究的不断深入,我国对于药物晶型的重视程度也不断提高,2015版《中华人民共和国药典》首次将药物晶型研究及晶型质量控制纳入指导原则5,2021年9月国家药品监督管理局发布《化学仿制药晶型研究指导原则》征求意见稿6。在技术和政策的双重推动下,药物的多晶型现象近些年来成为小分子药物研究的重点,也成为专利挑战的热点。
近几年,在对药物的活性成分——基础化合物的专利挑战中,药物晶型专利的无效请求屡见不鲜,据不完全统计,自2019年以来对于药物基础化合物的专利挑战中40%以上针对的是药物晶型的专利挑战,但仅依据新颖性这一项无效理由进行无效挑战的为数不多且成功率不高。尽管如此,新颖性这一无效理由仍然是无效请求人不愿放弃的理由之一。在无效审查实务中笔者发现,对于药物晶型专利新颖性的判断相对于药物基础化合物专利的判断更为复杂,目前在审查标准方面业内尚存在一些未达成一致的认识。例如,药物晶型专利新颖性的判定规则与基础化合物专利的判定规则是否相同?药物晶型新颖性判断的难点集中在法律判断还是技术判断上?在判断药物晶型专利是否被现有技术公开时,与药物化合物专利在事实认定上有哪些异同?为此,笔者收集了无效程序中涉及新颖性的部分案例,尝试通过这些案例探讨药物晶型专利新颖性判断的审查标准。
二、案例分析
在收集到的这些案例中,笔者发现在新颖性的无效争辩中,双方当事人的争议焦点主要集中在两个方面。第一、权利要求的保护范围如何界定,有当事人认为权利要求保护的药物晶型即说明书公开的具体药物晶型,也有观点认为权利要求的保护范围不完全等同说明书记载的具体药物晶型。第二、对于如何判断药物晶型专利是否具备新颖性众说纷纭,双方当事人对于专利保护的药物晶型是否被现有技术公开存在认识上的偏差。
1、如何确定药物晶型专利的保护范围
如上所述,研究发现药物晶型相对于药物基础化合物有其特殊性,但是“晶体化合物基于不同的分子排列,其物理化学参数可能存在差异,但其仍属化合物范畴”7,因此药物晶型专利的审查仍然属于化合物专利的审查范畴,其新颖性的判定规则与药物基础化合物专利新颖性的判定规则并无二致。在判断新颖性时,首先应当确定药物晶型专利权利要求的保护范围,然后再判断专利保护的药物晶型是否被现有技术公开。在判断权利要求的保护范围时,对于药物晶型专利与其它专利一样需要遵循新颖性判断的一般原则,均是以权利要求的主题名称和技术特征部分限定的范围为准,权利要求的撰写方式不同,其保护范围也不完全相同。
但是,与药物化合物权利要求相比,药物晶型权利要求保护范围的界定有其特殊之处。在界定化合物权利要求的保护范围时,通常可以通过化合物的化学名称或者结构式来确定化合物的结构,从而界定化合物的保护范围。但是药物晶型专利通常不能仅通过名称来确定其保护范围。因为化合物有统一的命名规范,根据化合物的化学命名可推知其化学结构,而药物晶型的命名尚没有统一的规范,随意性较大,其与微观结构之间也无关联,因此不能仅通过药物晶型的命名,例如“I型结晶”,来确定该晶型的具体微观结构。通常药物晶型领域的权利要求常常采用参数特征的形式在权利要求的特征部分对其微观结构进行限定,例如,采用粉末X射线衍射(PXRD)分析中的部分特征峰(2θ角或d值)限定、采用PXRD全图限定、采用晶胞参数限定等8,这些特征部分的限定最终决定了权利要求保护什么样的晶型。因此,药物晶型专利的主题名称往往限定的是某一化合物的结晶,其通常不能表示晶型的具体结构,而晶型的微观结构往往都在权利要求的特征部分用参数进行限定,因此限定了晶型具体微观结构的特征部分很大程度上决定权利要求的保护范围。
以下通过【案例1】说明,特征部分采用不同的参数限定导致药物晶型权利要求的保护范围不同,进而在对抗同一现有技术时,新颖性的判断可能出现两种截然不同的结论。
【案例1】9涉及的药物基础化合物为5-三氟甲基-2′-脱氧尿苷(即Trifluridine),说明书仅制备了一个Trifluridine的晶体,并分别用图1和表1记载了所述晶型的,其中表1共列出了36个峰的2θ、d值和相对强度,图1如下所示:
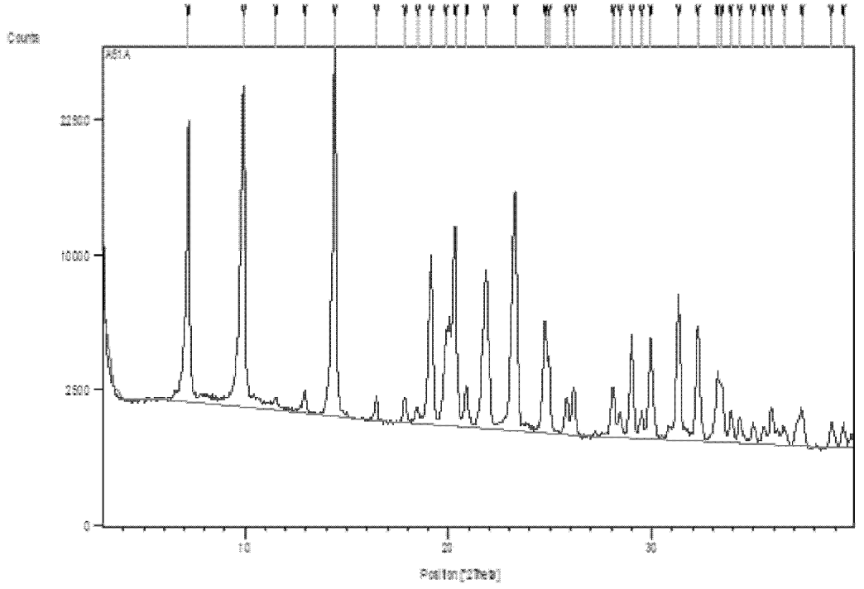
图1 【案例1】中制备得到的药物晶型的PXRD图谱
表1和图1的数据完全一致。其药物晶体权利要求如下“1. 一种式I所示Trifluridine化合物,
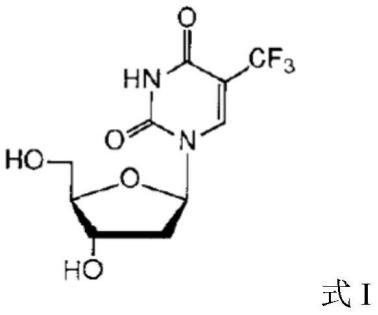
其特征在于,所述Trifluridine化合物为晶体形式,其X-射线粉末衍射图具有以2θ角度表示的7.21±0.2°、9.93±0.2°、14.41°±0.2°、19.15°±0.2°、20.33°±0.2°、21.84°±0.2°、23.27°±0.2°、31.30°±0.2°、19.88±0.2°、24.74±0.2°、24.94°±0.2°、29.01°±0.2°、29.94°±0.2°、32.25°±0.2°、33.23°±0.2°特征衍射峰。
2.如权利要求1所述的Trifluridine化合物,其特征在于,具有如图1所示的X-射线粉末衍射图。”
由权利要求1-2的对比可见,两者均保护“Trifluridine化合物的晶体”,权利要求1的特征部分限定了PXRD图中以2θ角度表示的15个特征衍射峰,权利要求2以“图1所示的X-射线粉末衍射图”作为特征部分的限定。上述权利要求的两种不同的限定方式是否保护范围相同?该案例的审查决定认为权利要求1和2的保护范围是不同的,理由是“权利要求1仅采用部分特征峰限定的形式,而没有限定衍射峰的相对强度、峰数量或衍射图”,“这时,判断新颖性应当以权利要求限定的特征为准,不应将仅在说明书中记载的详细衍射数据或衍射图作为比对的对象”,因此对于权利要求1技术特征的比较对象仅为2θ角度表示的15个特征衍射峰。而对于权利要求2由于其采用PXRD图进行限定,保护范围为以PXRD图表征的所述晶体,其技术特征的比较对象则为PXRD图,既包含图1显示的36个峰的2θ(d值),也包含图1显示的峰型、峰强度等特征。
上述案例说明,对于药物晶型专利特征部分采用不同的参数限定使其呈现出不同的保护范围,而判断药物晶型专利是否具备新颖性的前提在于先确定权利要求的保护范围,特别是这些参数限定隐含了哪些技术特征还需要本领域技术人员从技术上进行判断。目前本领域的普遍认知是“粉末衍射图谱如同人的指纹一样,是由衍射峰数量、衍射峰位置、衍射峰强度、衍射峰几何拓扑图特征组成。晶态下,晶胞参数决定了不同物质的衍射峰数量和位置,而组成晶型物质的分子则决定了每个衍射峰的强度。所以,那些仅考虑衍射峰数量和位置,而忽略衍射峰强度(相对强度,绝对强度)的晶型分析方法是十分错误的认识”10,“如果不考虑背底信号,衍射花样就是由衍射峰的峰位、峰型和峰强三部分构成”11。因此,该案例中由于权利要求1和2采用了不同的参数限定方式,其中权利要求1仅采用15个PXRD特征峰进行限定,其仅仅保护具有这15个特征峰位置的晶体,而权利要求2采用PXRD图谱进行限定,该图谱中不但包含了特征峰位置的信息,还包括特征峰的数量、峰型、特征峰的强度等信息,即两者特征部分限定的技术特征数量不同、内容也不同,导致两者限定了不同的保护范围。在药物晶型无效案件中晶型专利权利要求往往不是采用PXRD图谱对其进行限定,因此药物晶型专利权利要求保护的晶型并不完全等同于说明书中制备得到的以PXRD图谱表征的具体晶型。
2、如何判断药物晶型专利是否具备新颖性
确定权利要求的保护范围之后,新颖性判断的下一步则需要判断权利要求的所有技术特征是否被现有技术公开。在判断专利保护的药物晶型是否被公开时,与判断具体化合物是否被现有技术公开的方法相同,从法律层面上大致分为两种情形,一是专利保护的药物晶型是否“实际被公开”,二是专利保护的药物晶型是否“推定被公开”。
判断专利保护的药物晶型是否“实际被公开”时,通常应当站位本领域技术人员,以本领域的基本认知为基础,判断权利要求保护的药物晶型的每一个技术特征是否被对比文件公开。如上所述,如果采用PXRD特征峰位置对药物晶型进行限定,则在新颖性对比时仅需要考虑专利保护的药物晶型的特征峰位置是否被现有技术公开,如果采用PXRD全图谱对药物晶型进行限定,那么在对比时除需要对比特征峰位置是否被现有技术公开以外,还需要对比特征峰的数量、特征峰的相对强度是否也被公开。判断特征峰的位置和特征峰的相对强度是否被公开,需要站位本领域技术人员,了解本领域对于特征峰位置和峰强度相同(或实质上相同)的涵义。我国药典对药物晶型的鉴别规定,“晶型借鉴时利用供试品衍射峰的数量、位置(d或2θ)、强度(相对或绝对)、各峰强度之比等参量变化实现对晶型物质状态的鉴别。方法适用于晶态与晶态、晶态与无定型态、无定型态与无定型态等各种晶型物质的鉴别。若判断两个晶态样品的晶型物质状态一致时,应平行进行粉末X射线衍射试验,并满足衍射峰数量相同、二者2θ值衍射峰位置误差范围在±0.2°内、相同位置衍射峰的相对峰强度误差在±5%内,衍射峰的强弱顺序应一致”12。
下面通过两个案例说明,如何判断专利保护的药物晶型的特征是否被现有技术“实际公开”。
我们仍然引用上述【案例1】来讨论,请求人使用证据1认为其公开了权利要求利用布拉格方程经数据计算转换后得到的PXRD图,即证据1晶体的PXRD图谱,涉案专利制备得到的晶体PXRD图谱与证据3的对比图谱如下所示:
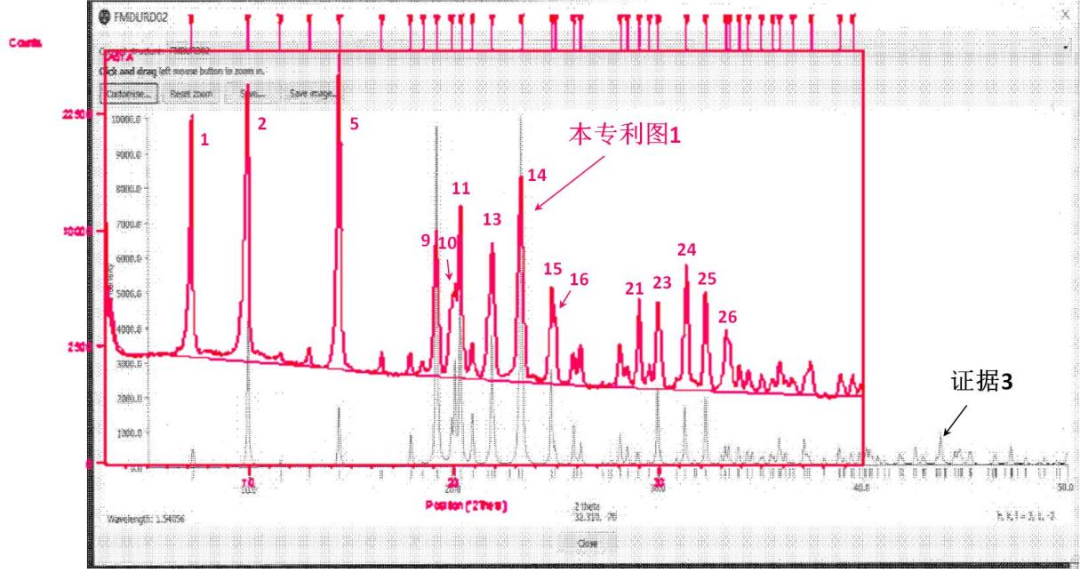
图2 【案例1】涉案专利权利要求2的晶型与证据3的PXRD图谱对比
表1:【案例1】权利要求1与证据3公开的特征峰数据对比
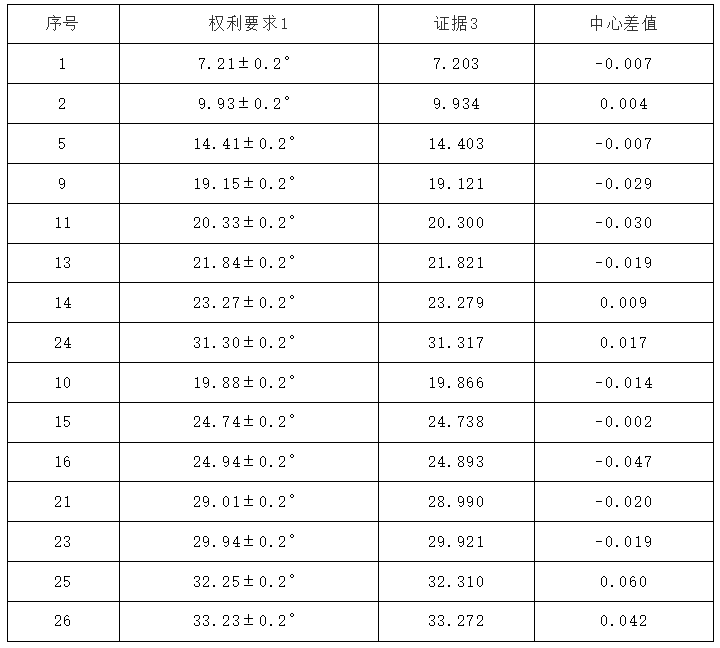
【案例1】决定认为,“证据3公开了15个衍射峰的位置与本专利基本重合,二者相差均小于0.2。但是各个峰的强度存在差异,例如本专利第5号峰最强,15个峰按相对强度由强到弱依次为第5、2、1、14、11、9、13、24、15、25、21、10、23、16、26号峰,而证据3第14号峰最强,15个峰按相对强度由强到弱依次为第14、9、11、2、13、10、15、25、5、24、10、16、26、21、1号峰。而且,证据3在2θ角度10-20°之间有多个峰缺失,在25-30°之间的峰数和多个峰型均与本专利图1不同,在上述15个特征衍射峰以外存在多个相对强度较大的衍射峰”,“衍射峰的峰位、峰型(几何拓扑图特征)、峰强中均含有晶体的结构信息。对于同一有机化合物的晶体而言,即便在所有衍射峰的位置都相同的情况下,若各衍射峰的峰型不同、相对峰强度相差较大、峰强顺序不同,表明微观晶体结构有所不同,尽管其晶胞参数可能非常接近,但代表了不同的晶型。”
由于证据1公开了权利要求1中的15个特征峰,且二者特征峰2θ相差均小于0.2°,在权利要求1限定的特征峰的误差范围内,因此【案例1】审查决定认为权利要求1保护的化合物晶型不具备新颖性。而对于权利要求2,审查决定认为其特征部分不仅包含36个特征峰(数量和位置)还包含各特征峰的峰型、峰强度(或相对强度)信息,由于权利要求2图1显示的峰强顺序、峰型、相对峰强度与证据3晶体的PXRD图谱显示的不同,且有多个特征峰未被证据1公开。因此,权利要求2不具备新颖性的无效理由不成立。
【案例2】13涉及药物“托吡司特”的I型结晶,权利要求1保护“4-[5-(吡啶-4-基)-1H-1,2,4-三唑-3-基]吡啶-2-腈的I型结晶,其在粉末X射线衍射中,在衍射角2θ的值为10.1、16.0、20.4、25.7以及26.7度附近具有特征性峰。”请求人认为附件2制备得到的“托吡司特”结晶与涉案专利保护的结晶相同,并对附件2制备得到的结晶进行了粉末X射线检测分析(注:附件2的制备和检测试验由独立第三方完成记载在附件3中),得到了PXRD图谱,其对附件2的制备重复了两次,得到的样品2θ的值与涉案专利的2θ的值分别见下表2:
表2:【案例2】权利要求与现有技术特征峰位置对比
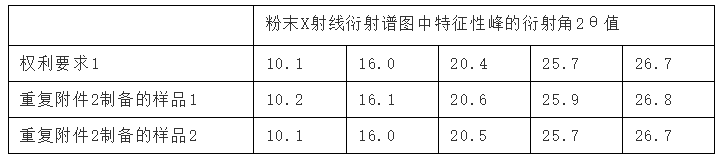
【案例2】决定认为“通过比对,以上特征峰位置均对应或在合理误差范围内(涉案专利说明书记载“X射线衍射中的±0.5度是其容许范围内的,是应该包含在本发明的权利范围的”),附件3实验内容证实了附件2实施例3(现有技术)得到的晶体与权利要求1中对于I型晶体的限定参数特征是一致的,二者是同一晶型,因此权利要求1不具备专利法第22条第2款规定的新颖性。” 【案例2】中,现有技术公开的PXRD特征峰位置与权利要求1限定的特征峰逐一对比时,均在本领域公认的误差范围内,因此认为涉案专利的晶型被现有技术公开。
上述两个案例说明,欲判断专利保护的药物晶型实际是否被现有技术公开,需要进行对比的是权利要求特征部分限定的每一个技术特征是否被现有技术对应公开。此时公开与否的判断要站位本领域技术人员,采用本领域技术人员认为药物晶型相同(或实质上相同)的标准,例如对于药物晶型如果采用PXRD图中特征峰的位置数据(例如d值或者2θ)进行限定,则直接对比所述位置的特征峰是否被现有技术公开,同时应当考虑本领域对于特征峰位置检测时对于同一位置特征峰鉴别可接受的误差范围是多大(例如涉案专利说明书的解释和/或“药典”中的规定),如果现有技术公开的晶型的特征峰位置落入权利要求限定的特征峰位置的误差范围之内则认定被实质上公开;如果药物晶型采用PXRD全图谱进行限定,则仅直接比对特征峰的位置是否被现有技术公开通常是不够的,还需要对比特征峰的数量、峰型、相对峰强度,只有在上述参数均被现有技术公开的情形下才能认可所述药物晶型被现有技术“实际公开”。上述“实际被公开”的判断采用的是新颖性判断的通用规则,即所有技术特征均被公开,或在本领域通常认可的误差范围内被认为实质上公开,则认为权利要求保护的技术方案被“实际公开”。
如上所述,药物晶型专利依然属于化合物专利的范畴,因此对于专利保护的药物晶型新颖性的判断除通用规则外,其也可以遵循化合物新颖性判断的特殊规则,即“推定新颖性”。但是其和化合物的“提及即公开”的推定方式内容上有些区别,专利审查指南第二部分第十章第5.1节对于“推定新颖性”的规定如下,“专利申请要求保护一种化合物的,如果在一份对比文件记载了化合物的化学名称、分子式(或结构式)等结构信息,使所述技术领域的技术人员认为要求保护的化合物已经被公开,则该化合物不具备新颖性,但申请人能提供证据证明在申请日之前无法获得该化合物的除外”。如上所述,由于药物晶型的名称不能反映其微观结构,其通过参数表征微观结构,如果现有技术没有公开药物晶型的参数特征,则仅能从药物晶型的获得方式上判断涉案专利与现有技术是否是同一晶型,如果两者获得晶型的方式相同或极其相似,则两者为同一晶型存在高度可能性,进而认为现有技术提及了涉案专利的晶型,导致专利保护的药物晶型“推定被公开”。此时,专利权人负有证明二者并非相同晶型的举证责任,如果举证不能则承担对其不利的法律后果。
【案例3】14涉及一种利格列汀的无水多晶型A,其在权利要求的特征部分限定了6个具体的PXRD特征峰,且确定第1个特征峰为最强峰,同时限定了熔点和晶格参数。其说明书部分记载,“WO2004/018468中所制备的该化合物在环境温度下是以两种互变性多晶型的混合物存在。该两种多晶型彼此转换的温度为25±15℃,可通过加热该混合物至大于40℃的温度获得纯的高温形态(多晶型A),其在206±3℃熔化”,“多晶型B是通过冷却至小于10℃的温度而获得”。其中WO2004/018468即为请求人使用的证据1的同族专利文献,其制备的化合物即利格列汀,在证据1中为化合物142(固体,熔点为198-202℃),请求人使用证据1化合物142欲证明涉案专利的无水多晶型A不具备新颖性,专利权人认为证据1化合物142的熔点与涉案专利晶型A熔点不重合,两者不是同一种晶体。
【案例3】的审查决定认为,“本专利说明书提到的以上WO2004/018468即为证据1的同族,根据以上内容可以确定,室温下证据1的化合物142应当为B晶型与A晶型的混合物,即证据1已经制备得到了利格列汀的A晶型,其仅仅是纯度不高,还包含有B晶型而已。其次,本专利说明书明确指出,通过加热该化合物至大于40℃的温度下可获得纯的A晶型,证据1公开了化合物142的熔点,该熔点(198-202℃)高于40℃。鉴于通常本领域测定熔点的方法是将固体化合物加热至熔融,因此在加热测定熔点的过程中升温至高于40℃的时候,证据1客观上已经得到了纯的A晶型,只是未确认具体的晶体参数。”
该案例中现有技术未公开涉案专利限定的特征峰、熔点和晶格参数,无法直接认定“实际公开”与否,但是证据1公开的化合物142固体获得和存在条件与涉案专利B晶型基本相同,因此对新颖性的判定采用 “推定新颖性”的规则。涉案专利和证据1为化学结构相同的同一个化合物,其在相同的条件下获得的固体形态的产物微观结构相同的可能性大,因而推定涉案专利保护的晶型被证据1公开。因为,证据1制备得到的利格列汀在室温下(25℃)和测定熔点的过程中,与涉案专利所述分别获得A晶型和纯的A晶型的条件相同。因此尽管证据1没有公开化合物142的晶体参数,但获得的142为固体化合物,其存在条件与涉案专利所述A晶型的存在条件一致,获得方式也一致,因此涉案专利与证据1为同一晶型存在高度可能性,推定涉案专利不具备新颖性。
【案例4】15权利要求保护利托那韦的多晶型物II,其采用21个PXRD特征峰对权利要求的特征部分进行限定,说明书实施例记载了多晶型物II的制备方法,“将非晶形利托那韦(40.0g)溶于沸腾的无水乙醇(100ml)中。一旦该溶液冷却至室温,得到饱和的溶液。在室温放置过夜后,经过滤从该混合物中分离所得固体,空气干燥,得到II型产物”。请求人使用化合物III(即利托那韦晶体)欲证明涉案专利保护的多晶型物不具备新颖性,其中证据1实施例2公开了化合物III的制备方法如下,“将残留物溶于乙酸乙酯中,再次将溶剂蒸馏,将残留物溶于乙酸乙酯中,升温至约60℃,直到得到澄清的溶液,将溶液过滤到干净的300加仑反应器中,冲洗的乙酸乙酯液过滤至该300加仑反应器中,将庚烷加入到该300加仑反应器中的乙酸乙酯溶液中,将该混合物加热至约80℃,直到得到清澈的溶液,将溶液以低于25℃/小时的速度冷却到22℃最终温度,自产物开始结晶后继续搅拌12小时,将浓稠的浆料分四批进行离心以分离产物,各批分离的产物均用约45kg乙酸乙酯/庚烷溶液洗涤,最后的洗涤液还用来冲洗反应器,产物在搅拌干燥器中于55℃真空下干燥24小时,得到101.9kg目标产物,熔点121-123℃”。
【案例4】的审查决定认为,“证据1并未公开晶体的具体晶型也没有相应的粉末衍射图谱,仅公开了其熔点范围,并且根据本专利说明书实施例的记载而言,证据1实施例2的制备方法与本申请制备方法并不相同,因此,无法判断两者公开的晶体是相同的晶体。”“在晶体领域中,不同的多晶型可通过已知的分析方法进行鉴别……其中XRD、晶体晶胞参数和空间群以及固相核磁共振(NMR)是相对准确的表征方式。因此,在本专利使用XRD数据表征晶型II,而证据1没有公开其晶体的XRD数据的情况下,由于两者制备方法并不相同,在请求人没有提供进一步证据的情况下,不足以证明二者是相同的晶型。”
由于上述案例的现有技术没有公开其制备得到的晶型的PXRD参数,无法与涉案专利保护的晶型进行比对,因而不能认定专利保护的晶型“实际被公开”,其新颖性的争议焦点则集中于专利保护的晶型是否应“推定被公开”。由于相同的结晶方法或者极其接近的结晶方法得到相同结晶的可能性较大,因此药物晶型专利“推定新颖性”适用的典型情形是涉案专利和现有技术制备晶型的方法高度近似从而可以合理认为其制备得到的晶型产物相同具有高度可能性。案例4中涉案专利采用沸腾的无水乙醇溶解非晶型利托那韦,冷却至室温静置过夜,分离干燥得到晶型II;现有技术采用利托那韦的乙酸乙酯和庚烷的混合溶液,在低于室温下冷却到22℃,结晶,分离干燥得到晶体。由于涉案专利和现有技术两者结晶溶剂不同,且两者结晶溶剂性质差别较大,结晶温度也不同,导致两者制备获得结晶的方法不同;此外,结晶溶剂和温度是决定结晶形式的关键技术手段,由于上述的不同导致两者获得结晶的方法也不相近,因而不能推定涉案专利被现有技术公开,无效请求人没有完成其证明责任。
从上述的案例分析可知,判断专利保护的药物晶型是否被现有技术公开的两种情形中前者应用是专利审查指南第二部分第三章新颖性判断的通用规则,当专利与现有技术相比“技术内容完全相同”,即可直接依据证据公开的事实认定专利保护的晶型不具备新颖性;后者则参照的是民事诉讼中民事证据证明标准的高度可能性规则,以及专利审查指南中关于化合物“推定”不具备新颖性的规则,“对负有举证证明责任的当事人提供的证据,人民法院经审查并结合相关事实,确信待证事实的存在具有高度可能性的,应当认定该事实存在”16,如果专利与现有技术获得晶型的方式完全相同或者极其接近,那么依据证据证明的事实判断专利与现有技术为相同的晶体存在高度可能性,从而推定专利保护的晶型不具备新颖性。如果专利权人举证证明现有技术无法获得所述晶型可能性则可以推翻上述推定。因此推定新颖性是在证据相对有限时,根据案情免除一方当事人举证责任并把不存在推定事实的证明责任转移给专利权人的一种法律认定。
三、小结
综上所述,药物晶型专利属于化合物专利的审查范畴,在判断新颖性时两者的审查思路相同,药物晶型新颖性的判断和化合物新颖性的判定一样都要先确定权利要求的保护范围和现有技术公开的技术方案,然后再进行技术事实公开与否的判定。但由于药物晶型的自身特点,判定新颖性时在判断内容和判断方式上也存在一些特殊之处,具体如下:
判断内容上,由于药物晶型的命名尚无统一的规范并与微观结构也无关联,因此与化合物新颖性事实认定的不同之处在于不能仅以命名相同判断晶型相同,由于晶型的微观结构由其特定的参数确定,例如PXRD(或晶胞参数)数据等,因此判断这些参数是否被现有技术公开是判定专利保护的药物晶型是否具备新颖性的关键。在判断限定药物晶型的参数是否公开时,需要了解现有技术对于同一药物晶型鉴别的规则,一方面需要考虑PXRD是药物晶型的指纹鉴别方式,不能仅仅以PXRD特征峰相同,即认为晶型相同,PXRD图谱的指纹信息除特征峰的数量和位置以外,还包括峰型、峰强度(或相对强度)等信息,都在晶型鉴别的考虑范围之列;另一方面需要考虑PXRD数据是检测得到的,因检测人员、样品等的不同必然存在一定的测量误差,如果上述PXRD指纹信息在本领域公认的测量误差范围内,则可以认为是相同的晶型,否则不能认定是相同的晶型。
判断方式上,与化合物专利以化学名称或化学结构限定权利要求的保护范围不同的是,药物晶型专利往往采用参数限定的方式来限定权利要求的保护范围,因此当现有技术公开晶型参数时,可以将涉案专利和现有技术两者进行比较,此时利用新颖性判断的通用规则,对比两者的晶型参数从而确定涉案专利是否被现有技术“实际公开”。当现有技术没有公开晶型参数时,此时新颖性的判断因为无法进行参数比较不能对 “实际公开”与否进行认定,但是可以利用民事证据证明标准的高度可能性规则,推定涉案专利是否被现有技术公开。此时推定依据的是涉案专利与现有技术获得晶型的方法是否相同或相似,如果两者方法相同或相似,两者为同一晶型存在高度可能性,则“推定被公开”,否则不能推定被公开。当涉案专利的晶型“推定被公开”时,如果有证据表明现有技术无法获得所述晶型,则“推定被公开”不成立。
参考文献:
1 王玉,热分析法与药物分析[M],中国医药科技出版社,2015年6月第1版,96。
2 ICH指导委员会,药品注册的国际技术要求质量部分[M],人民卫生出版社,2002年04月第1版,177-211。
3 杜冠华、吕扬,药物质量标准研究与药物质量控制[J],食品与药品,2008,10(5),1-4。
4 强桂芬等,我国晶型药物研究现状与发展方向[J],中国新药杂志,2009,18(13),1196-1200。
5 国家药典委员会,药品晶型研究及晶型质量控制指导原则[M],中华人民共和国药典,北京:中国医药科技出版社,2015版(四部),371-374。
6 https://www.cde.org.cn/zdyz/listpage/3c49fad55caad7a034c263cfc2b6eb9c[OL],2021年12月31日正式发布。
7 最高人民法院(2011)知行字第86号行政判决书。
8 胡杨、王轶、任晓兰,药物晶型发明无效宣告请求案创造性判断的探讨[J],中国专利与商标,2022年第1期。
9 国家知识产权局第50128号无效宣告请求审查决定书。
10 吕扬、杜冠华,晶型药物[M],人民卫生出版社,2009年10月第1版,129-130。
11 施洪龙、张谷令,X-射线粉末衍射和电子衍射——常用实验技术与数据分析[M],中央民族大学出版社,2014年07月第1版,120。
12 国家药典委员会,“9015 药品晶型研究及晶型质量控制指导原则”,《中华人民共和国药典》2020版 四部[M],北京:中国医药科技出版社,2020年05月第1版第1次印刷。
13 国家知识产权局第39166号无效宣告请求审查决定书。
14 国家知识产权局第53483号无效宣告请求审查决定书。
15 国家知识产权局第30364号无效宣告请求审查决定书。
16 《最高人民法院关于适用<中华人民共和国民事诉讼法>的解释》[M],第108条第1款。







 首页
首页 上一篇
上一篇 





评论